КИСЕЛИНИ
СЪЩНОСТ
Киселините са вещества, които участват в химични реакции с основи, приемайки електрони отдадени от основите. Повечето киселини с практическо значение са водоразтворими. При разтварянето си те се дисоциират на водородни катиони (H+) и киселинни аниони, а водородният им показател (pH) е по-малък от 7.
Примери за киселини:
- H2SO4 - сярна киселина
- HNO3 - азотна киселина
- CH3COOH - оцетна киселина
- HCl - солна киселина
- HClO - хипохлориста киселина
- H2CO3 - въглеродна киселина
- НF - флуороводородна киселина
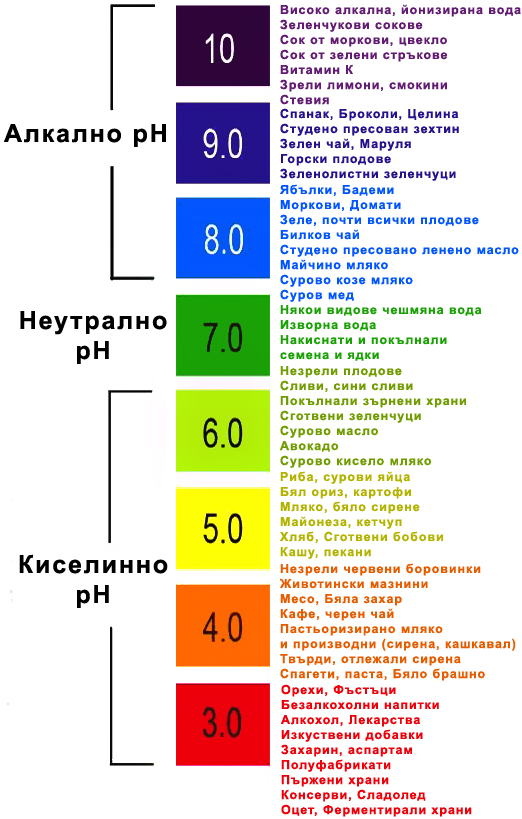
Храните и тяхното pH:
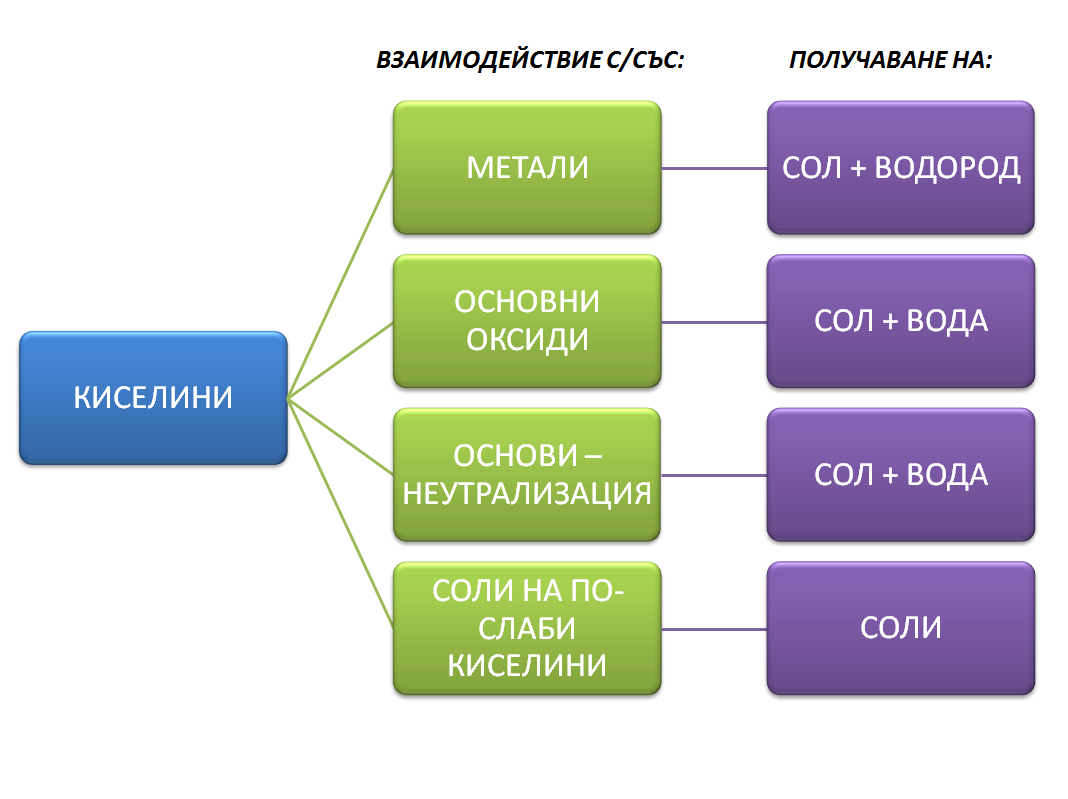
Участия в химични реакции:
Видове киселини:
Според състава си:
Според състава си киселините биват два вида:
- безкислородни, като например солната (HCl), бромоводородната (HBr), сяроводородната (H2S) и др.
- кислородсъдържащи - азотна киселина (HNO3), сярна киселина (H2SO4), перхлорна (HClO4)...
Според броя положителни водородни йони, които могат да се освободят (основност на киселините)
Разделени по този фактор, киселините биват три вида:
- едноосновни - HNO3, HNO2, HBr, CH3COOH...
- двуосновни - H2SO4, H2SO3, H2CO3, H2S...
- триосновни - H3PO4 (ортофосфорна киселина), H3AsO4 (арсениeва киселина)...
Според степента си на електролитна дисоциация (ЕД)
Степен на електролитна дисоциация (α) e равна на броя дисоциирани молекули върху общия брой разтворени молекули и се измерва в проценти.
- При α > от 30% - силни киселини - HCl, HBr, HI, H2SO4, HNO3, HClO4 и др.
- При 3% < α < 30% - средни по сила киселини - H2SO3, HNO2, HF...
- При α < 3% - слаби киселини - H2S, H2CO3, HCN (циановодородна киселина) ...